9.6.2024 - Ing. Aleš Smeták
V prvním článku o účincích elektrického proudu na lidský organismus jsme si nastínili, co všechno může elektrický proud způsobit.
Nyní již bezpečně víme, že negativní účinky proudu rostou s jeho rostoucí intenzitou. Záměrně volím slovo intenzita, protože nezáleží jen na množství proudu, ale i na době, po kterou lidským tělem prochází. Jinými slovy, čím většímu proudu nebo čím déle mu jsme vystaveni, tím větší z toho pro nás plynou rizika.
Článek však vyvolal dotazy ohledně jevu, který jsem v něm původně ani nezmiňoval, protože v něm zdaleka nejsem kovaný a na podobné téma jsem narazil i ve vášnivých diskuzích na sociálních sítích. Téma se týkalo především montérů solárních elektráren. Tím tématem je elektrolytický rozklad krve, který může přijít s časovým odstupem po úrazu.
Ti často řešili, zda mohou být v ohrožení života, pokud přes den utrpěli zásah stejnosměrným elektrickým proudem. Jinými slovy, měli obavy, zda i po několika hodinách mohou zemřít na elektrolytický rozklad krve.
Úkolem tohoto článku určitě není poskytnout informaci, jestli při úrazu stejnosměrným proudem po několika hodinách zemřete nebo ne. Dovolím si tvrdit, že na to nezná odpověď nikdo, protože každý organismus je jinak odolný, stejně jako je individuální odpor lidského těla, a navíc velmi záleží na velikosti a době průchodu elektrického proudu tělem. Co ale určitě všichni víme... na živé části se prostě nesahá a s elektřinou by měli pracovat jen kvalifikovaní pracovníci.
Úkolem článku tedy bude představit čtenáři jisté penzum znalostí o procesech v lidském těle a o chování elektrického proudu. Závěr o možném úmrtí na rozklad krve si pak čtenář jistě udělá sám.
Abychom si mohli udělat názor, musíme se prvně seznámit s některými pojmy, se kterými budeme následně pracovat.
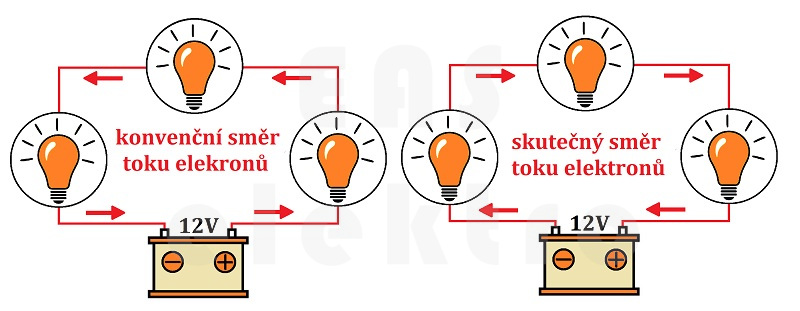
Je důležité rozlišit mezi konvenčním směrem proudu a skutečným pohybem elektronů.
Tradiční neboli konvenční směr elektrického proudu je definován jako tok kladných nábojů, tedy směr, kterým by se pohybovaly kladně nabité částice. Tento směr je od kladného pólu (plus) k zápornému pólu (mínus) zdroje napětí. Tato konvence vznikla historicky před objevem elektronů.
Ve skutečnosti se elektrony, které nesou náboj ve vodičích, pohybují opačným směrem, tedy od záporného pólu (mínus) ke kladnému pólu (plus). Skutečný směr elektrického proudu je tedy opačný než ten konvenční.
Než se pustíme do debaty nad elektrolýzou, je třeba si zapamatovat, že:
Konvenční směr proudu je od plus do mínus.
Skutečný pohyb elektronů je od mínus do plus.
Elektrolýza je proces, při kterém elektrický proud prochází roztokem obsahujícím volné ionty (elektrolytem), což vede k chemickým změnám na elektrodách.
Tento proces využívá elektrickou energii k vyvolání chemických reakcí a abychom mohli elektrolýzu spustit, budeme vždy potřebovat následující:
Když je na elektrody připojeno elektrické napětí, volné ionty (částice) v elektrolytu se začnou pohybovat směrem k opačně nabitým elektrodám. To znamená, že kladně nabité kationty míří k záporně nabité katodě a naopak záporně nabité anionty k kladně nabité anodě.
Na záporné katodě kladně nabité kationty přijímají elektrony a dochází k jejich redukci. Na anodě naopak záporně nabité anionty elektrony ztrácejí a dochází k jejich oxidaci. Výsledkem těchto reakcí je vylučování kovů, plynů nebo jiných chemických sloučenin na elektrodách.
Roztok NaCl, nazývaný také solný roztok nebo solanka, se obvykle elektrolýzuje v komerčních procesech, jako je výroba chlóru, vodíku a hydroxidu sodného (NaOH).
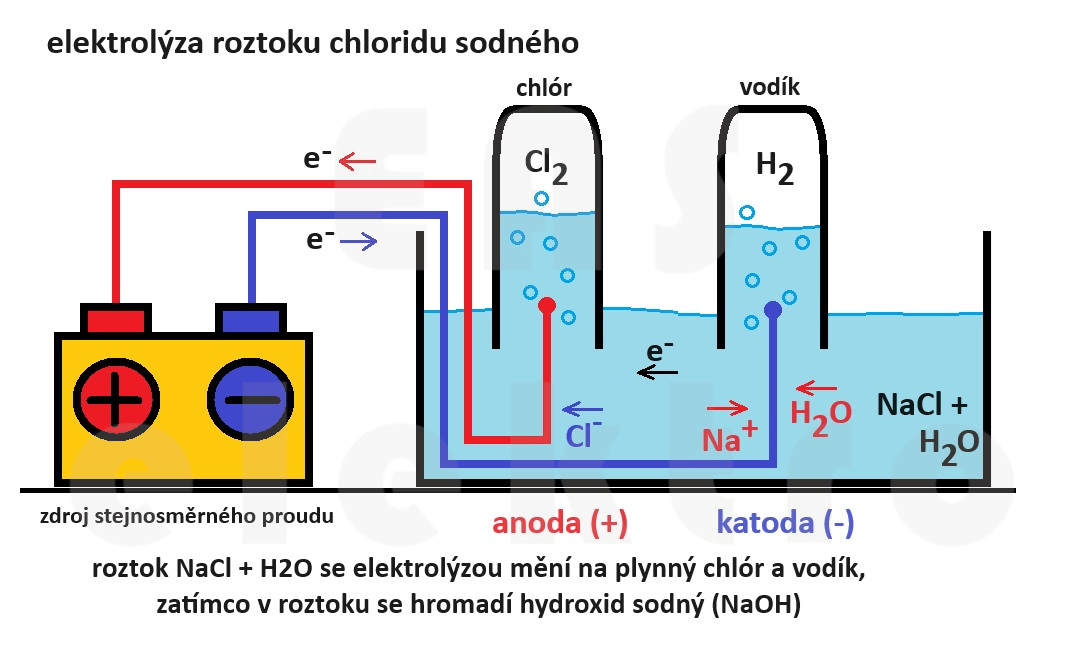
Nádržka obsahujíce elektrolytický roztok (solanku). Anoda je obvykle vyrobená z materiálu odolného vůči korozi, jako je třeba grafit a katoda bývá vyrobena z nerezové oceli nebo jiného odolného materiálu.
Na anodě probíhá oxidace chloridových iontů (Cl⁻) na plynný chlór (Cl₂) a na katodě naopak probíhá redukce vodíkových iontů (H⁺) na plynný vodík (H₂). V roztoku se také hromadí hydroxid sodný (NaOH).
Tohle doma raději nezkoušejte, protože elektrolýza roztoku NaCl produkuje plynný chlór, který je toxický a dráždivý, a hořlavý vodík. No on ani ten hydroxid sodný (NaOH) není žádný med.
Uvažujme elektrolytický proces, ve kterém máme měděnou anodu a elektrolyt je roztok síranu měďnatého, no prostě rozpuštěná modrá skalice.
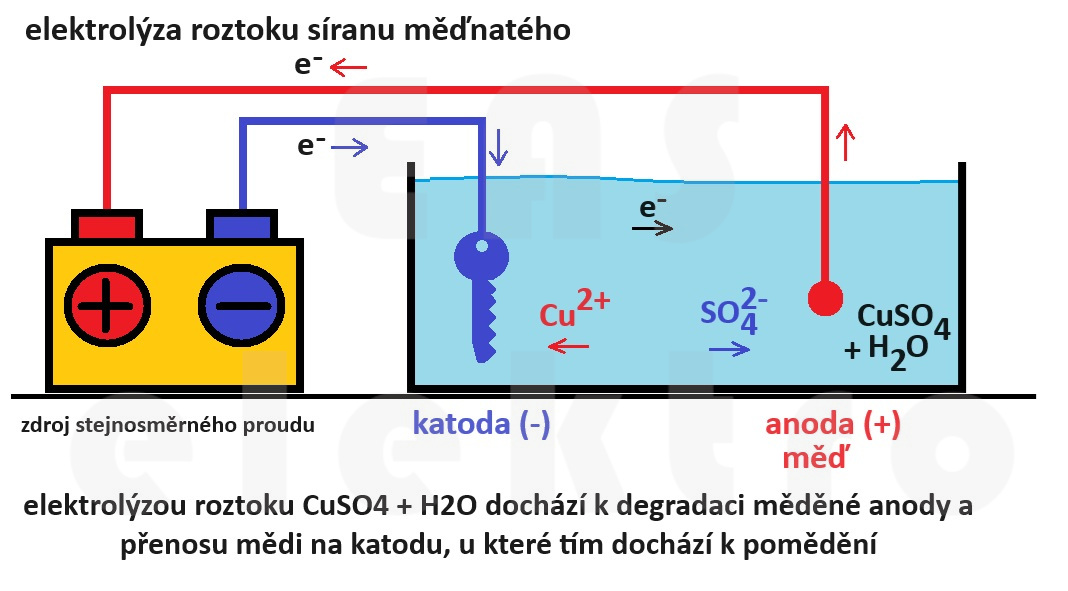
Kationty z elektrolytu putují ke katodě, kde přijímají elektrony a vylučují se jako neutrální atomy kovu (probíhá redukce). Tyto neutrální atomy se usazují na povrchu katody, což vede k nárůstu hmoty a zvětšování objemu katody.
Na anodě naopak probíhá oxidace, kdy atomy mědi z anody ztrácejí elektrony a přecházejí do roztoku jako kationty. Tento proces způsobuje úbytek hmoty anody, což vede k jejímu postupnému zmenšování.
Při dostatečně dlouhé elektrolýze by nakonec všechna měď skončila na katodě. Tento proces je typický pro elektrolytické čištění kovů, pokovování a jiné průmyslové aplikace elektrolýzy.
Dalším příkladem může být třeba elektrolýza vody, což je proces, při kterém se pomocí elektrického proudu rozkládá voda (H₂O) na kyslík (O₂) a vodík (H₂).
Tento proces vyžaduje elektrolyt (obvykle kyselinu nebo zásadu, například kyselinu sírovou nebo hydroxid sodný), který zvyšuje vodivost vody. Elektrodami jsou obvykle inertní materiály, jako je platina nebo grafit.

Po přivedení napětí vodíkové ionty (H⁺) přijímají elektrony (redukce) a tvoří molekuly vodíku (H₂). Naopak vodní molekuly na anodě ztrácejí elektrony (oxidace) a tvoří molekuly kyslíku (O₂) a vodíkové ionty (H⁺), které opět putují ke katodě.
Elektrolýza vody je tedy klíčovým procesem pro výrobu čistého vodíku a kyslíku.

Nyní již víme, co je zhruba elektrolýza a že stejnosměrné napětí na elektrodách (anoda a katoda) způsobí přesun elektronů od záporné anody ke kladně katodě a že cestou dochází k chemickým změnám na elektrodách i ke změnám elektrolytu.
Ze základky víme, že lidské tělo je tvořeno přibližně ze 60% vodou.

Co už nás však neučili, že tato voda se nachází ve dvou hlavních formách, tj. nitrobuněčná a mimobuněčná tekutina. Nitrobuněčná tekutina, jak název koneckonců napovídá, se nachází uvnitř buněk a tvoří přibližně 2/3 z celkového množství vody v těle. Tato tekutina obsahuje velké množství draslíku (K⁺), hořčíku (Mg²⁺), vápníku (Ca²⁺) a fosfátových iontů (HPO₄²⁻).
Naopak mimobuněčná tekutina obklopuje buňky, vyplňuje tkáňové meziprostory a tvoří tekutou složku krve (plazmu). Celkový podíl mimobuněčné tekutiny je asi 1/3 z celkové vody v organismu. Tato tekutina obsahuje vysoké koncentrace sodíku (Na⁺) a chloridu (Cl⁻).
Pokud bychom si představili člověka o váze 70kg, tak objem vody v jeho těle by byl asi 42 litrů, přičemž 28 litrů by bylo uvnitř buněk, 10 litrů různě v tělních dutinách a 4 litry v krvi. Samozřejmě, že poměry tekutin se mohou mírně lišit v závislosti na věku, pohlaví, tělesné kondici a zdravotním stavu.
Je tedy zřejmé, že voda v lidském těle tvoří většinu jeho hmoty, a navíc je plná kladně nabitých kationtů draslíku (K⁺), vápníku (Ca²⁺) a sodíku (Na⁺) a záporně nabitých aniontů chloridu (Cl⁻) a bikarbonátu (HCO₃⁻) ...
... hmm, nepřipadá vám to náhodou jako taková pěkná elektrolytická polívka?
Ne, to asi vážně nechcete... nebo?
Vše totiž záleží na velikosti proudu a době trvání, po kterou proud tělem procházel. Určitě je zbytečné mít obavy, že pokud jsme dostali výboj v délce trvání několika desetin vteřiny, že se nám rozložila krev. To je samozřejmě nesmysl.
Ale vraťme se zpět k elektrolýze a představme si, že nám nějakým způsobem vniká proud do těla v nezanedbatelném množství a po delší dobu... v takovém případě už nějaká rizika skutečně přichází.

Už víme, že stejnosměrný proud může způsobit elektrochemické reakce, které mohou ovlivnit vlastnosti elektrolytických roztoků a případě lidského těla to bude právě krev.
Vysvětlili jsme si, že krev je plná kladně nabitých kationtů jako jsou draslík (K⁺) a sodík (Na⁺) a záporně nabitých aniontů chloridu (Cl⁻) a bikarbonátu (HCO₃⁻).... nyní stačit jen pustit stejnosměrný proud.

Celkově tedy elektrolytický rozklad krve obsahuje celou plejádu chemických a fyzikálních procesů, které mohou vážně poškodit krevní buňky a další složky krve.
Elektrolytický rozklad krve je tedy přímo závislý na přítomnosti elektrického proudu, který iniciuje a udržuje elektrochemické reakce. Jakmile je proud přerušen, ionty přestanou migrovat k elektrodám, elektrochemické reakce se zastaví a nedochází k dalšímu rozkladu způsobenému elektrickým proudem.
Nicméně, poškození způsobené elektrolytickým rozkladem během doby, kdy byl proud aplikován, může mít následky, které přetrvávají i po přerušení proudu!
Zatímco samotný elektrolytický rozklad se po přerušení proudu zastaví, účinky tohoto procesu mohou vyžadovat čas na zotavení nebo mohou být trvalé, v závislosti na rozsahu a intenzitě působení proudu.
Bohužel se nedá odhadnout jaké zdravotní důsledky při průchodu proudu tělem u koho nastanou a za jakých podmínek. Někdo může snést větší proud po delší dobu bez následků a někdo může mít závažné zdravotní problémy i při malé expozici.
Nicméně jsem se s takovým případem nikdy nesetkal a jsem osobně přesvědčen, že elektrolytický rozpad krve může být příčinou úmrtí po úrazu elektrickým proudem jen velmi zřídka. Je totiž mnohem pravděpodobnější, že při setkání s elektřinou, bude příčina smrti spíše zástava srdeční činnosti nebo nějaké sekundární zranění.
Pokud jste v článku nalezli chybu, dejte nám, prosíme, o ní vědět na eas@eas-elektro.cz
Děkujeme, Eva a Aleš Smetákovi - návrat zpět na přehled článků